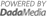| ▲ 단백질-금 복합 나노신소재의 작용 모식도 © 미래창조과학부 | |
단백질로 된 나노입자의 표면 위에 정상세포가 아닌 암세포에만 결합하는 펩타이드*와 금이 결합되어 함께 존재하는 나노신소재가 개발됐다. 암치료 목적으로 이용되는 광열치료**의 효율성과 안전성을 보다 높일 수 있는 실마리가 될 것으로 기대된다.
* 펩타이드 : 아미노산 50개 이하로 구성된 화합물. 아미노산은 단백질의 구성요소이다.
** 광열치료 : 금 나노입자가 근적외선 레이저를 흡수하여 발생하는 열을 이용하여 암 세포를 괴사시키는 암 치료법
고려대 이지원 교수와 한국과학기술연구원 김광명 박사가 주도한 이번 연구는 미래창조과학부가 추진하는 중견연구자지원사업(도약)과 선도연구센터지원사업의 지원으로 수행되었고, 첨단재료 분야 국제학술지 어드밴스드 머티리얼스지(Advanced Materials) 7월 8일자에 게재됐다.
암 부위에 금 나노입자를 전달한 후 레이저를 쬐는 광열치료법의 효과를 높이기 위해 체내 투과율이 높은 근적외선 레이저를 잘 흡수하고 광열효과가 뛰어난 직경 20nm 이상의 금 나노입자를 활용한 연구가 활발하다.
하지만 이 정도 크기의 금 나노입자는 체외 배출이 원활하지 않아 잠재적인 위험성이 있다고 보고되고 있으며, 암 부위로의 정확한 전달이 어려워 의료현장에서 적극적으로 활용되지 못하고 있다.
연구팀은 단백질 나노입자 표면에 암세포에 달라붙는 펩타이드와 직경 3nm 이하 초미세 금 나노닷이 동시에 결합되어 존재하는 단백질-금 복합 나노신소재를 개발했다.
만들어진 나노신소재는 정상세포가 아닌 암세포에만 결합하고 자발적인 단백질 변성을 통해 해체되어 몸 밖으로 쉽게 배출될 수 있어 보다 효율적이고 안전한 광열치료에 응용될 수 있을 것으로 기대된다.
이 나노신소재를 생쥐의 정맥에 주사한 결과 통상의 금 나노입자에 비해 암 발병부위로의 전달이 훨씬 효과적으로 이뤄졌다.
실제 인간 유방암 세포로 종양을 유도한 생쥐에 개발된 나노신소재를 이용, 근적외선 광열치료한 결과 암세포가 괴사되는 것을 확인하였다. 또한 3주간 생쥐의 장기와 조직을 살펴본 결과 금 나노닷이 잔존하지 않음을 확인하였다.
이는 정상세포가 아닌 암세포에만 결합할 수 있도록 인도하는 표적 펩타이드와 체외로 배출되기 쉬운 초미세 금 나노닷을 단백질 나노입자 표면에 동시에 도입한 데 따른 것이다.
이 교수는 “개발된 단백질-금 복합 나노신소재로 암 발병 부위로 선택적 전달 효능을 향상시켜 광열치료 효과를 극대화하는 한편 기존 금 나노입자의 체내축적으로 인한 장기/조직 문제를 해결할 수 있는 실마리가 될 것” 이라고 밝혔다.
남목노인복지관, ‘2026년에도 달리는 말처럼’ 온(溫)기 달림 키트 지원사업 진행 남목노인복지관[뉴스21일간=임정훈]사회복지법인 진각복지재단 남목노인복지관(관장 황상선)은 2월 11일(수), 울산동구 지역 취약계층 어르신 70세대를 대상으로 ‘2026년에도 달리는 말처럼’ 온(溫)기 달림 키트 지원 사업을 진행했다. 이번 사업은 억조금속(주)(사랑의열매 울산사회복지공동모금회 지원), 대한불교진각종 아축심인당, HD...

 서울시, 설 연휴 24시간 비상 의료체계 가동
서울시, 설 연휴 24시간 비상 의료체계 가동
 김종섭 울산시의회 부의장님과의 인터뷰
김종섭 울산시의회 부의장님과의 인터뷰

 목록으로
목록으로







 함흥시, 다자녀세대 우대법 명목으로 고아 입양 논의
함흥시, 다자녀세대 우대법 명목으로 고아 입양 논의
 평양, 반동사상문화배격법 위반 남성 공개 비판 진행
평양, 반동사상문화배격법 위반 남성 공개 비판 진행
 우크라이나, 올림픽 추모 헬멧 금지 IOC 결정 강력 비판
우크라이나, 올림픽 추모 헬멧 금지 IOC 결정 강력 비판
 미국, 나이지리아 군 훈련 위해 미군 200명 파견
미국, 나이지리아 군 훈련 위해 미군 200명 파견
 시진핑, 파키스탄 폭탄 테러에 조전 보내 애도
시진핑, 파키스탄 폭탄 테러에 조전 보내 애도